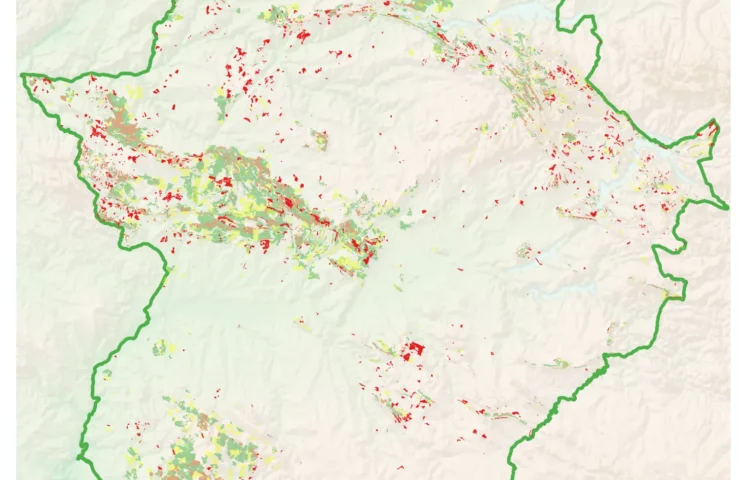
Diagnóstico
Los focos afectados por ‘seca’ responden a una serie de indicios, patrones y evidencias comunes que pueden ser utilizadas para descubrir la presencia del patógeno en el suelo.


La detección, diagnosis precisa e identificación de fitóftora se consideran aspectos fundamentales para la propuesta de medidas de control que prevengan la dispersión del patógeno (1).
Los métodos tradicionales de identificación de Fitóftora son imprescindibles para el aislamiento del patógeno vivo.
Identificación
Para confirmar la detección y proceder al aislamiento del Fitóftora se debe recurrir a un laboratorio microbiológico especializado en este tipo de patógenos.
Los métodos más empleados para la detección de Fitóftora en laboratorio son los métodos tradicionales. Sin embargo, en los últimos años se han incorporado otras técnicas de carácter molecular, basadas en el uso de ADN y anticuerpos, que han mejorado la sensibilidad y precisión en la detección de este patógeno.

Para detectar la presencia de Fitóftora es necesario tomar muestras del suelo y de raíces. Hay que tener en cuenta que un muestreo demasiado superficial, insuficiente o en puntos inadecuados puede dar como resultado un falso negativo.
Técnicas tradicionales
Phytophthora cinnamomi se puede aislar del suelo a partir de una muestra de suelo tomada de la rizosfera de un árbol enfermo. En laboratorio, sometemos la muestra a condiciones de inundación e incorporamos cebos vegetales como hojas tiernas de encina o raíces de altramuz (Lupinus luteus) para activar la generación y movilidad de zoosporas. Si el patógeno está presente, sus zoosporas atacarán el cebo y darán lugar a cambios de aspecto y color en los tejidos. Posteriormente, el material vegetal potencialmente infectado se siembra en un medio de cultivo selectivo que permitirá aislar al patógeno e identificarlo morfológicamente mediante la observación con el microscopio óptico. Las raicillas de las plantas infectadas pueden ser directamente cultivadas en estos medios selectivos para el aislamiento del oomicete.


Inundación de muestras de suelo, exposición a cebo vegetal y siembra de partes necrosadas.
Los métodos tradicionales son imprescindibles para aislar al patógeno vivo, aunque no sirven para obtener información cuando los niveles de población de fitóftora en el suelo son bajos. Para conseguir que la detección sea efectiva se deben tomar las muestras cuando la humedad del suelo y la temperatura están en óptimas condiciones para el desarrollo del patógeno (por ejemplo, en primavera después de las lluvias).
La falta de herramientas adecuadas para la identificación de fitóftora ha sido con gran probabilidad una de las causas por la que los daños y desórdenes ocurridos en entornos vegetales hayan sido atribuidos a otras causas bióticas (otros patógenos, plagas) o abióticas (humedad, temperatura, estado del suelo) (2).
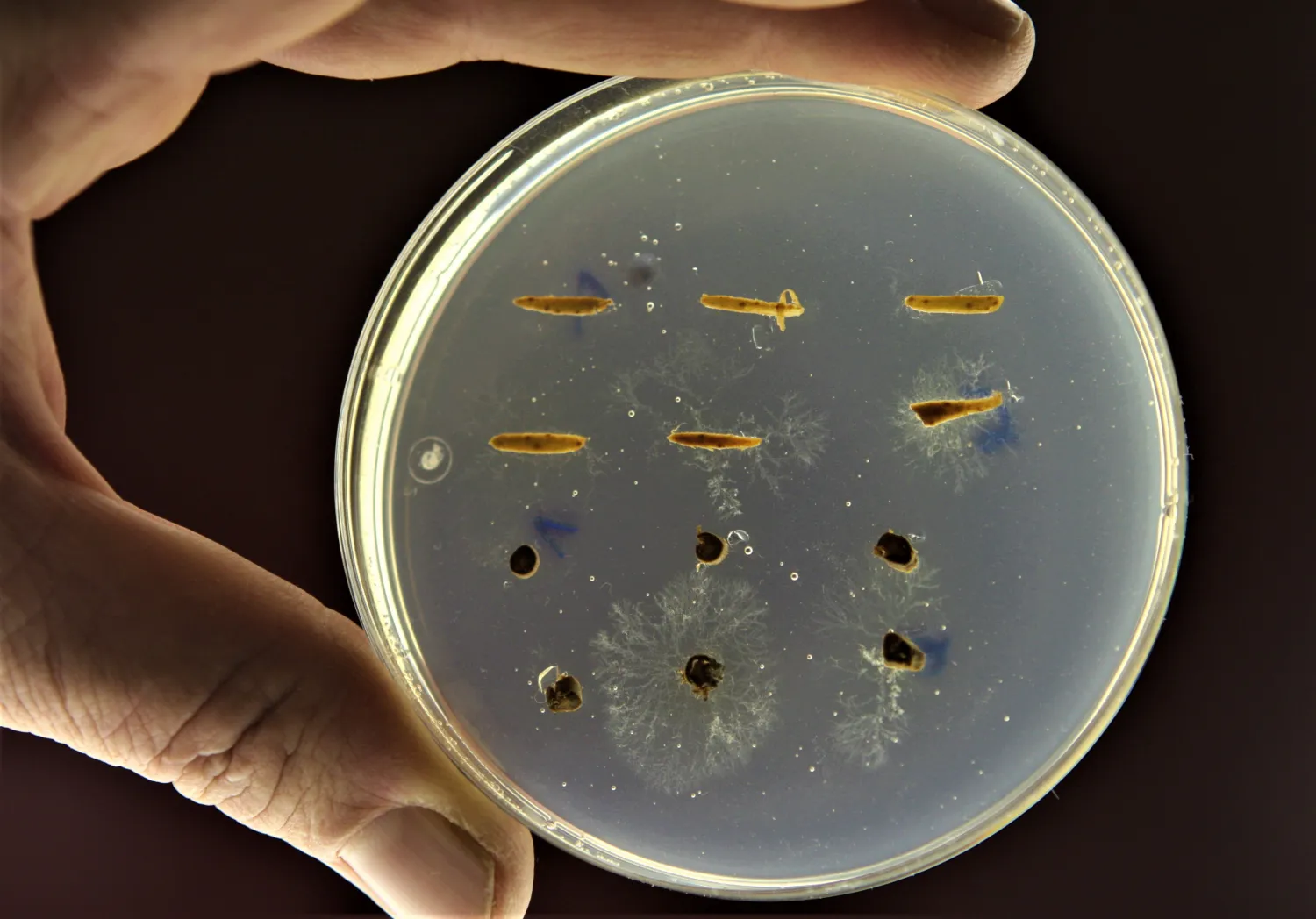
Crecimiento de P. cinnamomi en medio selectivo a partir de fragmentos de cebo vegetal.
Técnicas moleculares
El ensayo ELISA es probablemente el más utilizado para detectar organismos patógenos en los vegetales. Es un ensayo inmunológico basado en la unión de anticuerpos a antígenos (proteínas) concretos; la posterior detección de esos anticuerpos determinará la presencia de proteínas particulares en la muestra (por ejemplo, proteínas específicas de Fitóftora).
Los kits para ensayo ELISA diseñados para Fitóftora son muy sencillos de usar y presentan una alta sensibilidad, pudiendo detectar la presencia del patógeno en material vegetal con muy poco porcentaje de tejido infectado. No obstante, en ocasiones pueden dar como resultado falsos positivos al detectar otras especies semejantes a Fitóftora (3).
Por otra parte, las técnicas basadas en la detección de material genético han permitido detectar la presencia de Fitóftora aún partiendo de cantidades de inóculo ínfimas sin necesidad que el microorganismo esté vivo. Su especificidad se basa en las secuencias de ADN únicas existentes en el genoma de los organismos de la especie. La técnica de referencia en genética es la reacción en cadena de la polimerasa (PCR). Con este método podemos obtener una cantidad detectable de ADN de Fitóftora partiendo de tan solo unas copias de su material genético extraídas de la muestra de raíces o del suelo infectado.
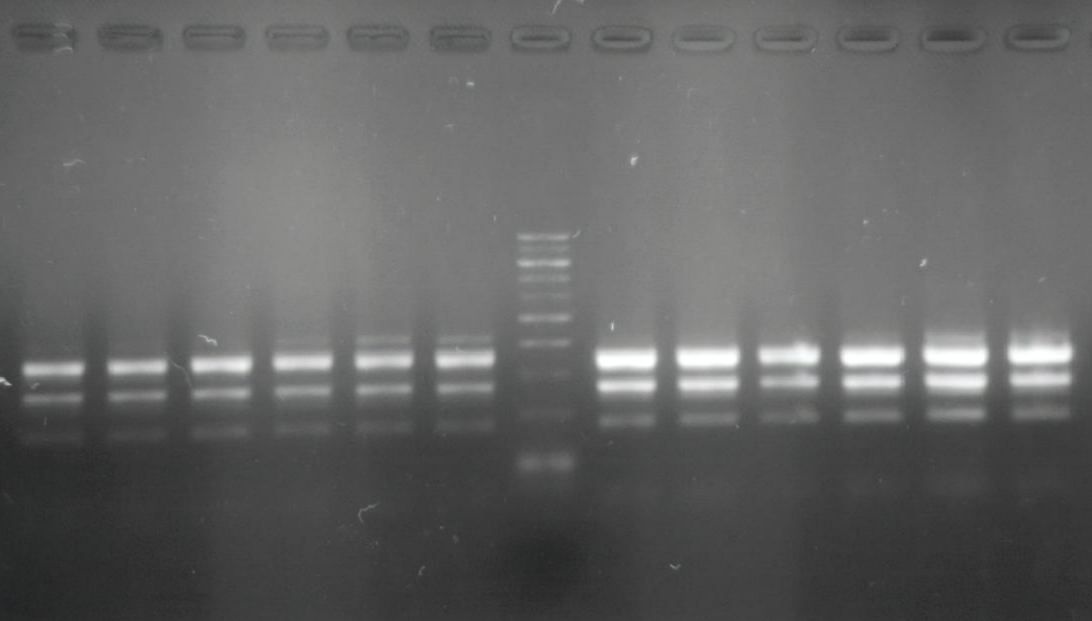
Electroforesis en gel de agarosa de fragmentos del ADN de P. cinnamomi amplificados por PCR.
Existen diversas variaciones de la PCR que mejoran su sensibilidad, como la PCR anidada, que parece ser un método adecuado para la detección de Fitóftora en los suelos (4), o bien la PCR cuantitativa o a tiempo real (qPCR) que ha supuesto una mayor automatización de la técnica, una disminución de los tiempos de ensayo y la capacidad de conocer con precisión la cantidad de inóculo del patógeno presente en la muestra original (5).
Otras técnicas más avanzadas se basan en la combinación de la PCR con la secuenciación (lectura) del ADN de diferentes zonas del genoma, lo que permite consultar las bases de datos genéticas (GenBank) para una identificación más precisa (6).
Referencias
(1) Cooke, D E L, Schena, L. & Cacciola, S.O., 2007. Tools to detect, identify and monitor Phytophthora species in natural ecosystems. Journal of Plant Pathology, 89(1), pp.13-28.
(2) Tsao, P.H., 1990. Why many Phytophthora root rots and crown rots of tree and horticultural crops remain undetected? EPPO Bulletin, 20(1), pp.11-17.
(3) O´Brien, P. a, Williams, Nari & Hardy, Giles E Stj, 2009. Detecting Phytophthora. Critical reviews in microbiology, 35(3), pp.169-81.
(4) Williams, N., Hardy, G. E. St. J. & O’Brien, P. a, 2009. Analysis of the distribution of Phytophthora cinnamomi in soil at a disease site in Western Australia using nested PCR. Forest Pathology, 39(2), pp.95-109.
(5) Li Z, Feng W, Zhu Z, Lu S, Lin M, Dong J, Wang Z, Liu F, Chen Q. Cas-OPRAD: a one-pot RPA/PCR CRISPR/Cas12 assay for on-site Phytophthora root rot detection. Front Microbiol. 2024 Jun 5;15:1390422. doi: 10.3389/fmicb.2024.1390422. PMID: 38903797; PMCID: PMC11188302.
(6) Engelbrecht J, Duong TA, Paap T, Hubert JM, Hanneman JJ, van den Berg N. Population genetic analyses of Phytophthora cinnamomi reveals three lineages and movement between natural vegetation and avocado orchards in South Africa. Phytopathology. 2022 Jul;112(7):1568-1574. doi: 10.1094/PHYTO-10-21-0414-R. Epub 2022 May 19. PMID: 35037471.